
Asit-baz Tepkimelerine Hangi Örnekler Verilebilir?
Asit-baz tepkimeleri, kimyasal reaksiyonların temel bir kategorisini oluşturur ve birçok günlük yaşam olayını etkiler. Bu yazıda, farklı asit-baz tepkimelerine örnekler verilerek, konunun anlaşılmasına yardımcı olunacaktır. Tepkimelerin doğası ve uygulama alanları, kimyanın önemini vurgulamaktadır.
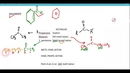
Asit-Baz Tepkimelerine Hangi Örnekler Verilebilir?Asit-baz tepkimeleri, kimyasal reaksiyonların önemli bir kategorisini oluşturmakta olup, genellikle asitlerin ve bazların birbirleriyle etkileşimi sonucu meydana gelen olaylardır. Bu tepkimeler, günlük yaşamda sıkça karşılaştığımız birçok durumu etkilemektedir. Aşağıda, asit-baz tepkimelerine örnekler verilerek bu konunun daha iyi anlaşılması sağlanacaktır. 1. Sodyum Hidroksit ve Hidroklorik Asit Tepkimesi Bu tepkime, en temel asit-baz tepkimelerinden biridir ve aşağıdaki gibi gerçekleşir:
Bu tepkime, nötralleşme tepkimesi olarak da bilinir ve genel formülü şu şekildedir:\[ \text{NaOH} + \text{HCl} \rightarrow \text{NaCl} + \text{H}_2\text{O} \] 2. Karbon Dioksit ve Su Tepkimesi Karbon dioksit (CO2) ve su (H2O) arasındaki tepkime, doğal asit-baz dengesinin bir örneğidir. Bu tepkime, canlı organizmalardaki solunum ve fotosentez süreçlerinde önemli bir rol oynamaktadır. Tepkime aşağıdaki şekilde gerçekleşir:
Bu durum, asit-baz dengesinin korunmasına yardımcı olur ve genel formülü şu şekildedir:\[ \text{CO}_2 + \text{H}_2\text{O} \rightleftharpoons \text{H}_2\text{CO}_3 \] 3. Asetik Asit ve Sodyum Asetat Tepkimesi Asetik asit (CH3COOH) ve sodyum asetat (CH3COONa) arasındaki tepkime, asit-baz kimyasında sıkça gözlemlenen bir durumu temsil eder. Bu tepkime, pH dengesinin sağlanmasında önemli bir rol oynar. Tepkime şu şekilde gerçekleşir:
4. Amonyak ve Asetik Asit Tepkimesi Amonyak (NH3) ve asetik asit (CH3COOH) arasındaki tepkime, zayıf bir baz olan amonyak ile zayıf bir asit olan asetik asit arasındaki etkileşimi gösterir. Bu tepkime aşağıdaki gibi gerçekleşir:
Bu tepkime, asit-baz tepkimelerinin dinamik dengesini göstermektedir. 5. Nitrik Asit ve Potasyum Klorür Tepkimesi Nitrik asit (HNO3) ile potasyum klorür (KCl) arasındaki tepkime, başka bir asit-baz tepkime örneğidir. Tepkime şu şekilde gerçekleşir:
Bu tepkimenin denklemi aşağıdaki gibidir:\[ \text{HNO}_3 + \text{KCl} \rightarrow \text{KNO}_3 + \text{HCl} \] Sonuç Asit-baz tepkimeleri, kimyada önemli bir yere sahip olup, birçok endüstriyel ve biyolojik süreçte yer almaktadır. Yukarıda verilen örnekler, bu tepkimelerin çeşitliliğini ve uygulama alanlarını göstermektedir. Asit-baz tepkimeleri, doğada ve laboratuvar ortamında sıkça karşılaşılan olaylar olup, birçok kimyasal işlemin temelini oluşturmaktadır. Bu nedenle, asit-baz tepkimelerinin anlaşılması, kimya ve ilgili bilim alanları için büyük bir öneme sahiptir. |








.webp)













.webp)
.webp)

Asit-baz tepkimeleri hakkında daha fazla bilgi edinmek benim için oldukça ilginç. Özellikle sodyum hidroksit ve hidroklorik asit tepkimesinin nitelendirilmesi dikkatimi çekti. Nötralleşme tepkimesi olarak adlandırılması, günlük hayatta sıkça karşılaştığımız örneklerden olduğunu gösteriyor. Bu bağlamda, karbon dioksit ve su tepkimesinin doğadaki rolü de göz ardı edilemez. Canlıların solunum ve fotosentez süreçlerinde nasıl bir etki yarattığını düşünmek beni düşündürüyor. Asetik asit ve sodyum asetat arasındaki tampon çözeltisi oluşturma durumu da pH dengesinin korunmasında ne kadar hayati bir öneme sahip olduğunu gösteriyor. Bu tepkimelerin dinamik dengesinin nasıl sağlandığı ve nitrik asit ile potasyum klorür tepkimesi gibi daha karmaşık reaksiyonlar arasındaki ilişkiyi merak ediyorum. Genel olarak, asit-baz tepkimelerinin kimya ve doğa bilimleri için bu denli kritik bir öneme sahip olması, bu konuyu daha derinlemesine incelememi sağlıyor. Sizce bu tepkimelerin günlük hayatta başka hangi örnekleriyle karşılaşabiliriz?
Teoman,
Asit-Baz Tepkimeleri ve Nötralleşme
Asit-baz tepkimeleri, kimya dünyasında önemli bir yer tutar. Özellikle sodyum hidroksit ve hidroklorik asit tepkimesi, günlük hayatta sıkça karşılaştığımız bir nötralleşme tepkimesidir. Bu tür tepkimeler, pH dengesinin sağlanmasında kritik rol oynar ve birçok endüstride kullanılır.
Karbon Dioksit ve Su Tepkimesi
Karbon dioksit ve su tepkimesi, doğada önemli bir yere sahiptir. Canlıların solunum ve fotosentez süreçlerinde bu tepkimelerin etkisi oldukça büyüktür. Örneğin, fotosentez sırasında bitkiler, CO2 ve suyu kullanarak oksijen ve glikoz üretirler. Bu süreç, yaşam döngüsü için hayati önemdedir.
Asetik Asit ve Sodyum Asetat
Asetik asit ve sodyum asetat arasındaki tampon çözeltisi oluşturma durumu, pH dengesinin korunmasına yardımcı olur. Bu tür tampon sistemler, biyolojik süreçlerde ve laboratuvar uygulamalarında oldukça önemlidir.
Günlük Hayatta Diğer Örnekler
Günlük hayatta asit-baz tepkimeleriyle karşılaştığımız diğer örnekler arasında, yemeklerde kullanılan sirke (asetik asit) ve karbonat (sodyum bikarbonat) yer alır. Ayrıca, temizlik ürünlerinde de asit-baz tepkimeleri sıkça kullanılır.
Karmaşık Reaksiyonlar
Nitrik asit ile potasyum klorür tepkimesi gibi daha karmaşık reaksiyonlar, asit-baz dengesinin yanı sıra, kimyasal tepkimelerin dinamik dengesini anlamamıza yardımcı olur. Bu tür tepkimeleri incelemek, kimyanın temel prensiplerini daha iyi kavramamızı sağlar.
Sonuç olarak, asit-baz tepkimeleri, hem kimya hem de doğa bilimleri açısından büyük bir öneme sahiptir. Bu konuyu daha derinlemesine incelemek, bilimsel anlayışımızı geliştirecektir.