
Asetik asidin ph değeri nedir ve nasıl hesaplanır?
Asetik asidin pH değeri, asidin konsantrasyonu ve çözeltinin sıcaklığına bağlı olarak değişir. Zayıf bir asit olduğundan, pH hesaplaması belirli bir dengeye dayanır. Bu yazıda, asetik asidin pH değerinin nasıl hesaplandığı ve etkileyen faktörler ele alınacaktır.
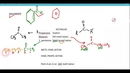
Asetik Asidin pH Değeri ve Nasıl Hesaplanır?Asetik asit, kimyasal formülü C₂H₄O₂ olan, organik bir asit olup, sulu çözeltilerde zayıf asidik özellikler gösterir. Asetik asidin pH değeri, çözeltinin asidik özelliklerini belirlemek için önemli bir parametredir. Bu makalede, asetik asidin pH değerinin ne olduğu ve bu değerin nasıl hesaplandığı detaylı bir şekilde ele alınacaktır. Asetik Asidin pH Değeri Asetik asidin su ile karıştığında ortaya çıkan pH değeri, asidin konsantrasyonuna ve çözeltideki sıcaklığa bağlı olarak değişir. Asetik asit, zayıf bir asit olduğu için tamamen iyonlaşmaz. Bu durum, pH değerinin hesaplanmasını zorlaştırır. Genellikle, 1 M (mol/litre) konsantrasyona sahip asetik asidin pH değeri yaklaşık 2.4 civarındadır. Ancak, bu değer daha düşük konsantrasyonlarda yükselebilir. Asetik Asidin İyonlaşma Denge Dengesi Asetik asidin su içinde iyonlaşma denklemi şu şekildedir: CH₃COOH ⇌ CH₃COO⁻ + H⁺Burada, CH₃COOH asetik asidi, CH₃COO⁻ ise asetat iyonunu temsil eder. Bu denklemin denge durumu, asetik asidin dissosiyasyon derecesine bağlıdır. Asetik asidin dissosiyasyon sabiti (Ka) aşağıdaki gibi tanımlanır: Ka = [CH₃COO⁻][H⁺] / [CH₃COOH]Bu denkleme göre, asetik asidin pH'ını hesaplamak için öncelikle konsantrasyonlar arasındaki dengeyi sağlamalıyız. pH Hesaplama Yöntemi pH değeri, hidrojen iyonu konsantrasyonunun negatif logaritması olarak tanımlanır: pH = -log[H⁺]Asetik asidin pH değerini hesaplamak için aşağıdaki adımlar izlenir:
Örnek Hesaplama Örneğin, 0.1 M konsantrasyona sahip asetik asidin pH değerini hesaplayalım: 1. İlk olarak, 0.1 M asetik asit için başlangıç konsantrasyonu C = 0.1 M alınır. 2. Asetik asidin dissosiyasyon sabiti Ka = 1.8 x 10⁻⁵ olarak bilinir. 3. Asetik asidin dengesi için: - [H⁺] = x - [CH₃COO⁻] = x - [CH₃COOH] = 0.1 - x Bu durumda, denge denklemi: Ka = x² / (0.1 - x) Bu denklemden x değerini bulduktan sonra, [H⁺] konsantrasyonu elde edilir ve pH değeri hesaplanabilir. Ek Bilgiler Sonuç olarak, asetik asidin pH değeri, çözeltinin konsantrasyonuna ve sıcaklığına bağlı olarak değişiklik göstermektedir. pH hesaplama, bu asidin zayıf asidik özelliklerini anlamak için önemli bir araçtır. Bu bilgiler, kimya ve biyokimya alanında daha derin bir anlayış sağlamaktadır. |








.webp)













.webp)
.webp)

Asetik asidin pH değeri ve hesaplanma süreci hakkında daha fazla bilgi edinmek isterken, pH değerinin konsantrasyona bağlı olarak değiştiğini belirtmek önemli. Özellikle 1 M asetik asidin pH değerinin 2.4 civarında olması, zayıf asitlerin davranışını anlamak açısından ilginç. Peki, daha düşük konsantrasyonlarda pH değerinin neden yükseldiğini düşündün mü? Ayrıca, dissosiyasyon denklemi ve Ka değerinin pH hesaplamasındaki rolü hakkında daha fazla bilgi edinmek, bu kimyasal süreçleri anlamana yardımcı olabilir. Bu konuda daha fazla örnek hesaplama yapmayı düşündün mü?
Merhaba Ayasun,
pH Değeri ve Konsantrasyon İlişkisi
pH değeri, bir çözeltinin asidik veya bazik özelliklerini belirler ve bu değer, çözeltideki hidrojen iyonu konsantrasyonuna bağlıdır. Asetik asit gibi zayıf asitler, konsantrasyonları azaldıkça daha az hidrojen iyonu saldığı için pH değerleri yükselir. Yani, 1 M asetik asidin pH değeri 2.4 civarındayken, daha düşük konsantrasyonlarda bu değer artış gösterir.
Düşük Konsantrasyonlarda pH Değerinin Yükselmesi
Daha düşük konsantrasyonlarda asetik asit, tamamen dissosiyasyona uğramadığı için serbest hidrojen iyonu konsantrasyonu azalmaktadır. Bu durum, pH değerinin yükselmesine neden olur. Zayıf asitlerin dissosiyasyon denklemleri ve Ka değeri, bu sürecin anlaşılmasında kritik bir rol oynar.
Dissosiyasyon Denklemi ve Ka Değeri
Asetik asidin dissosiyasyon denklemi şu şekildedir:
CH₃COOH ⇌ H⁺ + CH₃COO⁻
Bu denkleme göre, asetik asit su içinde zayıf bir şekilde iyonlaşır. Ka (asidik dissosiyasyon sabiti) değeri, asetik asidin ne kadar dissosiyasyona uğradığını gösterir. Ka değeri ile pH hesaplamalarında, asidin konsantrasyonu ve iyonlaşma oranı dikkate alınarak pH değeri hesaplanabilir.
Örnek Hesaplama
Evet, örnek hesaplamalar yapmak, bu konudaki anlayışını derinleştirebilir. Farklı konsantrasyonlarda asetik asidin pH değerini hesaplamak, zayıf asitlerin davranışını daha iyi kavramana yardımcı olabilir. İlgili hesaplamalar ve örnekler üzerinde çalışmak, öğrenme sürecini pekiştirecek ve konuyu daha iyi anlamanı sağlayacaktır.
Umarım bu bilgiler senin için faydalı olur!