
Asit ve baz reaksiyonları nasıl gerçekleşir?
Asit ve baz reaksiyonları, kimyasal etkileşimlerin temelini oluşturur ve önemli tepkimeleri kapsar. Bu süreçler, asitlerin ve bazların birbirleriyle etkileşimleri sonucu tuz ve su oluşumunu içerir. Farklı teorilerle tanımlanan bu reaksiyonlar, birçok endüstriyel uygulamada kritik bir rol oynar.
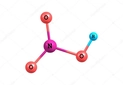
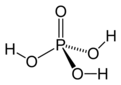
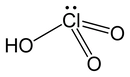
Asit ve Baz Reaksiyonları: Temel Kavramlar Asit ve baz reaksiyonları, kimyasal bileşiklerin birbiriyle etkileşimleri sonucunda meydana gelen önemli tepkimelerdir. Bu tepkimeler, asitlerin ve bazların birbirleriyle etkileşimi sonucu tuz ve su oluşturma süreçlerini içerir. Asit ve bazların tanımları, çeşitli teorilere dayanmaktadır. Bu teoriler arasında Arrhenius, Brønsted-Lowry ve Lewis teorileri bulunur. Asit ve Baz Tanımları Asitler, su içinde çözündüklerinde hidrojen iyonları (H⁺) salan maddelerdir. Bazlar ise su içinde çözündüklerinde hidroksit iyonları (OH⁻) üreten maddelerdir. Aşağıda asit ve bazların tanımları daha detaylı bir şekilde açıklanmıştır:
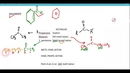
Asit-Baz Reaksiyonlarının Genel Formu Asit-baz tepkimeleri genel olarak şu şekilde ifade edilebilir:Asit + Baz → Tuz + SuBu tepkime örnek olarak, hidroklorik asit (HCl) ile sodyum hidroksit (NaOH) arasındaki etkileşim verilebilir: HCl + NaOH → NaCl + H₂OBu tepkimede, hidroklorik asit bir asit olarak H⁺ iyonu verirken, sodyum hidroksit OH⁻ iyonu sağlar. Sonuç olarak, sodyum klorür (NaCl) ve su (H₂O) oluşur. Asit-Baz Reaksiyonlarının Önemli Özellikleri Asit-baz reaksiyonları, birçok önemli özelliğe sahiptir:
Asit-Baz Reaksiyonlarının Uygulamaları Asit-baz reaksiyonları birçok alanda önemli uygulamalara sahiptir:
Sonuç Asit ve baz reaksiyonları, kimyanın temel taşlarından biridir ve birçok endüstriyel ve bilimsel uygulamada kritik bir öneme sahiptir. Bu reaksiyonların anlaşılması, kimyasal süreçlerin kontrol edilmesi ve yeni maddelerin sentezlenmesi açısından oldukça önemlidir. Asit ve bazların tanımlanması ve bu maddelerin etkileşimlerinin incelenmesi, kimya biliminin gelişimine katkıda bulunarak, daha karmaşık kimyasal sistemlerin anlaşılmasını kolaylaştırır. |








.webp)













.webp)
.webp)

Asit ve baz reaksiyonlarının kimyasal süreçlerdeki rolü hakkında daha fazla bilgi edinmek istiyorum. Özellikle Arrhenius, Brønsted-Lowry ve Lewis teorileri arasındaki farkları nasıl daha iyi anlayabilirim? Bu teorilerin pratikteki uygulamaları nelerdir? Ayrıca, asit-baz tepkimelerinin günlük yaşamda nasıl karşımıza çıktığını merak ediyorum. Örneğin, evde kullanmakta olduğumuz temizlik ürünlerinde bu tür reaksiyonlar var mı?
Asit ve Baz Reaksiyonlarının Rolü
Asit ve baz reaksiyonları, kimyasal süreçlerde önemli bir yer tutar. Bu reaksiyonlar, birçok endüstriyel üretimden, biyokimyasal olaylara kadar pek çok alanda kritik öneme sahiptir.
Teoriler Arasındaki Farklar
Arrhenius teorisi, asitleri suya eklediğimizde hidrojen iyonu (H⁺) veren, bazları ise hidroksit iyonu (OH⁻) veren maddeler olarak tanımlar. Brønsted-Lowry teorisi ise asitleri proton (H⁺) veren, bazları ise proton kabul eden maddeler olarak tanımlar. Lewis teorisi ise daha geniş bir yaklaşımla, asitleri elektron çeken ve bazları elektron veren maddeler olarak tanımlar. Bu teoriler arasındaki fark, tanımladıkları asit ve baz kavramlarının kapsamı ve uygulama alanlarıdır.
Pratikteki Uygulamalar
Bu teorilerin pratikteki uygulamaları oldukça geniştir. Örneğin, Arrhenius teorisi genellikle su bazlı çözeltilerde asit-baz davranışlarının anlaşılmasında kullanılırken, Brønsted-Lowry teorisi daha karmaşık sistemlerde proton transferinin incelenmesine olanak tanır. Lewis teorisi ise organik kimya ve koordinasyon kimyasında sıkça kullanılır.
Günlük Hayatta Asit-Baz Tepkimeleri
Günlük yaşamda asit-baz tepkimeleri sıkça karşımıza çıkar. Örneğin, evde kullandığımız temizlik ürünleri genellikle asidik veya bazik özellikler taşır. Sirke (asit) ve karbonat (baz) gibi maddeler, temizlikte etkilidir ve bu maddelerin reaksiyonu, kirlerin ve lekelerin temizlenmesine yardımcı olur. Ayrıca, bazı temizlik ürünlerinin formülasyonlarında asit-baz reaksiyonları, pH dengesinin sağlanması açısından kritik bir rol oynar.