Hcl asit midir yoksa baz mıdır?
Hidroklorik asit (HCl), güçlü bir asit olarak bilinir ve çeşitli kimyasal özellikleri ile dikkat çeker. Bu içerikte, HCl'nin asidik yapısı, asit-baz teorileri ve endüstrideki kullanımları detaylandırılmaktadır. Ayrıca, HCl'nin sağlık ve çevre üzerindeki etkileri de ele alınmaktadır.
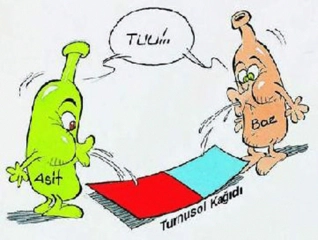
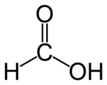
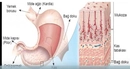
HCl Asit midir Yoksa Baz mıdır?Hidroklorik asit (HCl), kimyasal bileşenleri arasında hidrojen (H) ve klor (Cl) bulunan güçlü bir asittir. Bu makalede, HCl'nin asidik özellikleri, asit-baz teorileri ve HCl'nin çeşitli alanlardaki kullanımları ele alınacaktır. HCl'nin Kimyasal Yapısı Hidroklorik asit, sulu çözeltide bulunan bir asit olup, klorür iyonları (Cl⁻) ve hidrojen iyonları (H⁺) oluşturur. HCl, su ile birleştiğinde güçlü bir asit olarak davranır ve pH değeri 1-2 arasında değişir. Bu düşük pH değeri, HCl'nin asidik özelliklerini göstermektedir. Asit-Baz Teorileri HCl'nin asit olduğunu belirlemek için birkaç temel asit-baz teorisi kullanılabilir:
HCl'nin Özellikleri HCl, birkaç önemli özelliğe sahiptir:
HCl'nin Kullanım Alanları Hidroklorik asit, endüstriyel ve laboratuvar ortamlarında yaygın olarak kullanılmaktadır:
Sonuç Sonuç olarak, HCl kesinlikle bir asittir. Asidik özellikleri, kimyasal yapısı ve çeşitli teorilere göre asit olarak sınıflandırılması, HCl'nin bu kategoride yer aldığını göstermektedir. HCl'nin birçok endüstriyel ve laboratuvar uygulaması, onu önemli bir kimyasal madde haline getirmektedir. HCl'nin asidik doğası, çeşitli kimyasal reaksiyonlarda ve uygulamalarda temel bir rol oynamaktadır. Ekstra Bilgiler HCl'nin sağlık üzerindeki etkileri de dikkate alınmalıdır. Konsantre HCl, cilt ve gözle temas ettiğinde ciddi yanıklara neden olabilir. Bu nedenle, HCl ile çalışırken uygun güvenlik önlemlerinin alınması gerekmektedir. Ayrıca, HCl'nin çevresel etkileri de göz önünde bulundurulmalıdır; asidik yağmur oluşumuna katkıda bulunabilir ve bu da ekosistemlerde olumsuz etkilere yol açabilir. |








.webp)













.webp)
.webp)