
Sulu çözelti hangi asit-baz sınıfına aittir?
Sulu çözeltilerin asit-baz sınıflandırılması, kimya alanında kritik bir konudur. Bu yazıda, asitlerin ve bazların tanımlanması üzerine farklı teoriler, pH değerinin önemi ve asit-baz tepkimelerinin kimyasal süreçlerdeki rolü ele alınacaktır.
Sulu Çözelti Hangi Asit-Baz Sınıfına Aittir?Sulu çözeltilerin asit-baz sınıflandırması, kimya alanında önemli bir konudur. Asitlerin ve bazların tanımlanması, farklı teorilere dayanmaktadır. Bu makalede, sulu çözeltilerin asit-baz sınıflandırması üzerine detaylı bir inceleme yapılacaktır. Asit ve Baz Tanımları Asit ve baz kavramları, çeşitli teorilerle tanımlanmıştır. Başlıca tanımlamalar şunlardır:
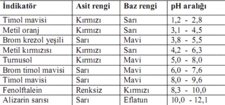
Sulu Çözeltilerin Asit-Baz Sınıflandırması Sulu çözeltilerin asit veya baz olarak sınıflandırılması, pH değeri ile doğrudan ilişkilidir. pH değeri, çözeltinin asidik veya bazik olduğunu belirleyen bir ölçüdür.
Asit-Baz Tepkimeleri ve Sulu Çözelti Asit-baz tepkimeleri, asitlerin ve bazların birbirleriyle etkileşime girmesiyle gerçekleşir. Bu etkileşimler, genellikle proton transferi yoluyla gerçekleşir. Sulu çözeltilerde, bu tepkimelerin önemi büyüktür; çünkü birçok kimyasal reaksiyon su ortamında gerçekleşir.
Sonuç Sulu çözeltiler, asit-baz sınıflandırmalarında önemli bir yere sahiptir. Arrhenius, Brønsted-Lowry ve Lewis teorileri, asitlerin ve bazların tanımlanmasında farklı bakış açıları sunmaktadır. pH değeri, sulu bir çözeltinin asidik, bazik veya nötr olup olmadığını belirlerken, asit-baz tepkimeleri kimyasal süreçlerin temelini oluşturur. Bu nedenle, sulu çözeltilerin asit-baz sınıflandırması, kimya alanında temel bir konudur ve birçok uygulama ve araştırma için önem taşımaktadır. Ek olarak, sulu çözeltilerin asit-baz özellikleri, biyolojik sistemlerde, endüstriyel süreçlerde ve çevresel olaylarda kritik öneme sahiptir. Bu nedenle, bu konu üzerindeki araştırmalar ve çalışmalar devam etmektedir. |








.webp)













.webp)
.webp)

Sulu çözeltilerin asit-baz sınıflandırması hakkında verilen bilgiler oldukça kapsamlı ve aydınlatıcı. Arrhenius, Brønsted-Lowry ve Lewis teorileri arasındaki farkları anlamak, asit ve bazların kimyasal özelliklerini daha iyi kavramamıza yardımcı oluyor. Özellikle pH değerinin, bir çözeltinin asidik, bazik veya nötr olduğunu belirlemedeki rolü çok önemli. Acaba, bu teorilerin pratikteki uygulamaları nelerdir? Örneğin, günlük yaşamda sıkça karşılaştığımız asit-baz tepkimeleri hangi durumlarda karşımıza çıkıyor?
Orgül, yazdıklarınız gerçekten önemli noktalara değiniyor.
Teorilerin Pratikteki Uygulamaları
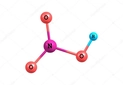
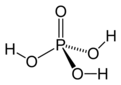
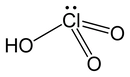
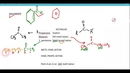
Arrhenius, Brønsted-Lowry ve Lewis teorileri, asit-baz kimyasını anlamamızda temel taşlar niteliğinde. Örneğin, Arrhenius teorisi, asitlerin su içinde H⁺, bazların ise OH⁻ iyonu ürettiğini belirtir; bu durum, pH ölçümleri ile günlük yaşamda sıkça karşılaştığımız asit ve bazların belirlenmesinde kullanılmaktadır. Brønsted-Lowry teorisi ise asitlerin proton verici, bazların ise proton alıcı olduğunu öne sürer. Bu, mide asidi ve antasitlerin etkileşimi gibi durumlarda önemli bir rol oynar. Lewis teorisi ise daha geniş bir perspektif sunarak, elektron çiftlerinin aktarımı üzerinden asit-baz tepkimelerini açıklar; bu, organik kimyada birçok reaksiyonun anlaşılmasına yardımcı olur.
Günlük Yaşamda Karşılaştığımız Asit-Baz Tepkimeleri
Günlük yaşamda sıkça karşılaştığımız durumlar arasında, yiyeceklerin asidik veya bazik özellikleri, temizlik ürünlerinin etkisi ve sağlıkla ilgili durumlar yer alır. Örneğin, limon suyu (asit) ve soda (baz) tüketimi, vücudun pH dengesini etkileyebilir. Ayrıca, temizlik ürünlerinde bulunan asitler ve bazlar, yağ ve kirin çözülmesinde etkilidir. Mide asidi ile antasitler arasındaki etkileşim de sıkça karşılaştığımız bir asit-baz tepkimesidir. Bu tür etkileşimler, asit-baz teorilerini günlük yaşantımızda nasıl gözlemlediğimizi gösteriyor.
Sonuç olarak, asit-baz teorilerinin günlük yaşamda pratikteki uygulamaları, kimyasal özellikleri anlamamıza yardımcı olduğu gibi, sağlığımızdan temizlik alışkanlıklarımıza kadar geniş bir yelpazede etkili olmaktadır.