
Kuvvetli asit ve baz tepkimeleri nasıl gerçekleşir?
Kuvvetli asit ve baz tepkimeleri, su içinde tamamen iyonlaşabilen maddeler arasındaki etkileşimleri kapsar. Bu tepkimeler, asit-baz teorileri çerçevesinde proton transferi ve iyonlaşma süreçleriyle gerçekleşir. Kimya alanındaki temel konulardan biridir.
Kuvvetli Asit ve Baz Tepkimeleri Nasıldır?Kuvvetli asitler ve bazlar, su içinde tamamen iyonlaşabilen maddelerdir. Bu tepkimeler, asit-baz teorileri çerçevesinde açıklanabilir ve bu süreçlerin anlaşılması, kimya biliminin temel taşlarından birini oluşturur. Bu makalede, kuvvetli asit ve bazların tepkimeleri detaylı bir şekilde ele alınacaktır. Asit ve Baz Tanımları Asitler, su içinde proton (H⁺) veren maddelerdir. Bazlar ise, su içinde hidroksit iyonu (OH⁻) üreten veya proton kabul eden maddelerdir. Bu noktada önemli olan, kuvvetli asitlerin ve bazların su içinde tamamen iyonlaşma yetenekleridir.
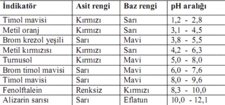
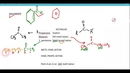
Asit-Baz Tepkimesinin Mekanizması Kuvvetli asit ve bazların tepkimesi, genel olarak aşağıdaki gibi gerçekleşir: 1. İyonlaşma: Kuvvetli asit su içinde H⁺ iyonları ve anyonlar şeklinde tamamen iyonlaşır. 2. Reaksiyon: Kuvvetli baz, su içinde OH⁻ iyonları ve katyonlar şeklinde tamamen iyonlaşır. 3. Tepkime: H⁺ ve OH⁻ iyonları bir araya gelerek su moleküllerini oluşturur. Bu süreç sırasında ekzotermik bir tepki meydana gelir; yani ısı açığa çıkar. Tepkime genel olarak aşağıdaki denklemlerle ifade edilebilir: H⁺(aq) + OH⁻(aq) → H₂O(l) Bu süreçte, asit ve bazın konsantrasyonuna bağlı olarak, tepkimenin denge durumu da göz önünde bulundurulmalıdır. Örnek Tepkime: HCl ve NaOH Bir örnek olarak hidroklorik asit (HCl) ile sodyum hidroksit (NaOH) arasındaki tepkimeyi ele alalım: HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l) Bu tepkimede, HCl kuvvetli bir asit olarak H⁺ ve Cl⁻ iyonlarına, NaOH ise kuvvetli bir baz olarak Na⁺ ve OH⁻ iyonlarına ayrışır. Sonuç olarak, H⁺ ve OH⁻ iyonları birleşerek su oluşturur ve geriye NaCl çözeltisi kalır. Asit-Baz Denge Teorisi Kuvvetli asit ve baz tepkimeleri, asit-baz denge teorisi ile de açıklanabilir. Bu teoride, asitlerin ve bazların birer proton verici ve alıcı olduğu kabul edilir. Kuvvetli asitlerin, su ile tepkimeye girmesi sonucu oluşan hidrojen iyonları, ortamın pH seviyesini düşürürken, kuvvetli bazların hidroksit iyonları pH seviyesini yükseltir. Sonuç Kuvvetli asit ve baz tepkimeleri, iyonlaşma süreci ve proton transferi mekanizması ile gerçekleşir. Bu tepkimelerin anlaşılması, hem teorik hem de uygulamalı kimya açısından son derece önemlidir. Kimyasal denge, pH hesaplamaları ve çeşitli endüstriyel uygulamalar, kuvvetli asit ve baz tepkimelerinin temel bilgilerini gerektirir. Ek Bilgiler |








.webp)













.webp)
.webp)

Kuvvetli asit ve baz tepkimeleri hakkında yazdıklarınız oldukça bilgilendirici. Bu tepkimelerin mekanizmasının anlaşılması, kimya eğitimi açısından ne kadar önemli, değil mi? Özellikle hidroklorik asit ve sodyum hidroksit arasındaki tepkime örneği, asit-baz tepkimelerinin günlük hayatta nasıl işlediğini çok iyi gösteriyor. Ayrıca, asitlerin ve bazların pH üzerindeki etkileri de gerçekten dikkat çekici. Sizce, bu tür tepkimelerin laboratuvar ortamında doğru bir şekilde yapılması için hangi güvenlik önlemlerine daha fazla dikkat edilmesi gerekiyor?
Vusta,
Kuvvetli Asit ve Baz Tepkimeleri hakkında yazdıklarının bilgilendirici olduğunu belirtmen çok sevindirici. Gerçekten de bu tepkimelerin mekanizmasının anlaşılması, kimya eğitimi açısından oldukça önemlidir. Asit-baz tepkimeleri, günlük hayatta sıkça karşılaştığımız olaylardır ve hidroklorik asit ile sodyum hidroksit arasındaki tepkime, bu durumun en iyi örneklerinden biridir. Bu tür tepkimeler sayesinde, pH kavramının yanı sıra asit ve bazların özelliklerini daha iyi kavrayabiliyoruz.
Laboratuvar Güvenliği açısından, kuvvetli asit ve bazlarla çalışırken dikkat edilmesi gereken bazı önemli önlemler bulunmaktadır. Öncelikle, uygun kişisel koruyucu ekipmanların (gözlük, eldiven, laboratuvar önlüğü) kullanılması şarttır. Ayrıca, çalışılan alanın iyi havalandırılması, bu maddelerin buharlarının solunmasını önlemek için gereklidir. Tepkime sırasında meydana gelebilecek sıçramalara karşı güvenli bir alan oluşturulmalı ve acil durumlarda kullanılacak olan yangın söndürücüler ile ilk yardım ekipmanlarının kolay ulaşılabilir bir yerde bulundurulması önemlidir.
Sonuç olarak, kimya eğitiminde bu tür tepkimelerin anlaşılması bir temeldir ve güvenli bir laboratuvar ortamında çalışmak, hem öğretim hem de uygulama açısından kritik bir rol oynamaktadır.