
Ca(OH) 2 asit mi yoksa baz mı olarak sınıflandırılır?
Kalsiyum hidroksit (Ca(OH)2), su içinde çözündüğünde hidroksit iyonları (OH⁻) salarak bazik özellikler gösterir. Bu makalede, Ca(OH)2'nin kimyasal yapısı, asit-baz teorileri bağlamında sınıflandırılması ve çeşitli kullanım alanları detaylandırılacaktır.
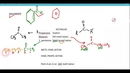
Ca(OH) 2 Asit mi Yoksa Baz mı Olarak Sınıflandırılır?Kalsiyum hidroksit (Ca(OH) 2), yaygın olarak "sönmüş kireç" olarak bilinen bir bileşiktir. Su içinde çözündüğünde, hidroksit iyonları (OH⁻) salarak bir baz olarak davranır. Bu makalede, Ca(OH) 2'nin kimyasal özellikleri, davranışları ve asit-baz teorileri çerçevesinde nasıl sınıflandırıldığı detaylı bir şekilde ele alınacaktır. Ca(OH) 2'nin Kimyasal Yapısı Kalsiyum hidroksit, Ca²⁺ kationu ve iki OH⁻ anyonundan oluşur. Kimyasal formülü Ca(OH) 2 olan bu bileşik, suda çözündüğünde aşağıdaki dengeyi kurar:
Bu denge, kalsiyum hidroksitin suda çözünerek hidroksit iyonları salmasına neden olur. Bu durum, Ca(OH) 2'nin bazik özelliklerini ortaya koyar. Asit-Baz Teorileri Asit-baz kimyasında, çeşitli teoriler bulunmaktadır. Bu teoriler, bileşiklerin asit veya baz olarak sınıflandırılmasında önemli bir rol oynamaktadır. İki temel teori aşağıda açıklanmıştır:
Ca(OH) 2'nin Kullanım Alanları Kalsiyum hidroksit, birçok endüstride ve bilimsel uygulamada önemli bir bileşiktir. Kullanım alanlarından bazıları aşağıda sıralanmıştır:
Sonuç Kalsiyum hidroksit (Ca(OH) 2), hem Arrhenius hem de Brønsted-Lowry teorileri çerçevesinde bir baz olarak sınıflandırılmaktadır. Suyun içinde çözündüğünde, hidroksit iyonları salarak bazik özellikler gösterir. Ca(OH) 2'nin çeşitli endüstriyel ve bilimsel uygulamaları, bu bileşiğin önemini gözler önüne sermektedir. Kısacası, Ca(OH) 2, asit değil, güçlü bir bazdır. Ekstra Bilgi: Ca(OH) 2'nin çözünürlüğü, sıcaklık ile artar; bu, özellikle su arıtma işlemlerinde etkinliğini artırır. Ayrıca, kalsiyum hidroksit, pH düzeyini yükselterek asidik ortamlarda denge sağlama yeteneğine sahiptir. Bu özellikleri, onu birçok kimyasal işlemde vazgeçilmez kılar. |








.webp)













.webp)
.webp)

Ca(OH)2'nin baz olarak sınıflandırılmasının nedenlerine dair verdiğiniz bilgiler oldukça açıklayıcı. Kalsiyum hidroksitin suda çözündüğünde hidroksit iyonları salmasının, onu bir baz olarak tanımlamanızda etkili olduğunu düşünüyorum. Arrhenius ve Brønsted-Lowry teorileri açısından değerlendirilmesi, bu bileşiğin asit-baz kimyasındaki yerini net bir şekilde ortaya koyuyor. Özellikle tarımda pH seviyesini artırmak ve su arıtma süreçlerinde kullanımı, Ca(OH)2'nin pratikteki önemini de vurguluyor. Bu tür bir bileşiğin ne kadar çok alanda kullanılabileceği ve sağladığı faydalar gerçekten dikkat çekici. Kısacası, bazik özellikleri ve uygulama alanlarıyla Ca(OH)2'nin kimyasal dünyadaki yerini daha iyi anlamamı sağladınız.
Merhaba Erdim,
Yorumunuz için teşekkür ederim. Ca(OH)2'nin baz olarak sınıflandırılmasının arkasındaki kimyasal nedenler gerçekten de oldukça dikkate değer. Hidroksit iyonları salarak bazik özellikler göstermesi, Arrhenius ve Brønsted-Lowry teorileri çerçevesinde net bir tanım sağlar.
Tarımda pH seviyesini artırma ve su arıtma süreçlerindeki kullanımı, bu bileşiğin günlük hayattaki önemini ve faydasını gözler önüne seriyor. Kalsiyum hidroksit gibi bileşiklerin çok yönlü kullanımları, kimyanın pratik uygulamalarını anlamamıza oldukça yardımcı oluyor. Gerçekten de, Ca(OH)2'nin kimyasal dünyadaki yeri, özellikleri ve fonksiyonları ile daha derinlemesine bir anlayışa kavuşmamızı sağlıyor.
Görüşlerinizi paylaştığınız için teşekkürler.